青木生物技术(武汉)有限公司代理商
7 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 2.7
- 2.7
青木生物技术(武汉)有限公司
入驻年限:7 年
- 联系人:
刘经理
- 所在地区:
湖北 武汉市 洪山区
- 业务范围:
体外诊断、细胞库 / 细胞培养、试剂、抗体、ELISA 试剂盒、实验室仪器 / 设备
- 经营模式:
代理商 经销商 生产厂商
推荐产品
公司新闻/正文
如何识别并避免免疫分析中的干扰?
2597 人阅读发布时间:2024-09-19 09:02
所有的免疫分析方法的特征是在目标分析物和抗体之间的结合反应。这些方法存在的问题是经常发生的干扰,导致了错误的检测,这个问题至今未得到充分地解决。典型的干扰有非特异性结合,导致较差的信噪比和高背景, 交叉反应和基质效应。简单地说,这些效应大多是基于分析物、捕获抗体或检测抗体与外部物质或表面的直接相互作用。图 1 表示了一种典型干扰效应的简化方案。在技术文献中经常被描述的已知的干扰因素有如异嗜性抗体和 HAMAs(人抗小鼠抗体)、类风湿性因子、白蛋白、补体,溶菌酶以及其他等。
免疫分析标记带来的干扰
在免疫分析中标记检测抗体非常常见,譬如在竞争法中,标记待测分析物。经常使用的标记有酶(碱性磷酸酶或(辣根)过氧化物酶)、荧光染料、放射性同位素或 DNA(用于免疫 PCR)。不必要的影响也出现在这里。危险在于,使用荧光染料作为标记,这类疏水染料会改变检测抗体的结合能力,导致染料本身的非期望的结合,且降低了标记 蛋白的溶解度。此外,抗原与抗体的结合也会变弱。例如,这些非特异性效应会导致抗体与表面 (图 1A 和 B)、与样品中的外部蛋白质 (图 1C) 或对捕获抗体 (图 1D) 的结合增加。在这些情况下,会导致在没有分析物存在时出现假阳性或整个检测出现高背景。在蛋白质芯片上观察到单个斑点的背景荧光增加,或信噪比完全变糟糕。同样,血清样本中的蛋白质或抗体也可以与荧光染料结合,减少甚至封闭染料的荧光。因此,一些研究人员已经建议放弃荧光染料作为蛋白质阵列的标记或选择其他标记。蛋白质芯片上的反应是非常复杂的,因为在一个反应体系中同时使用多种不同的捕获抗体和标记的检测抗体。因此,样本中蛋白质或标记抗体与单点的非特异性结合的概率升高, 同时样本中成分与抗体的结合带来的干扰效应也随之增加。
交叉反应带来的干扰
交叉反应是指抗体也与目标分析物以外的其他结构结合的能力 (图 1, I-K)。通常这些结构与被分析物有很大的相似性。因此,具有相似分子结构的代谢物或化学物质就是例子。氨基酸序列具有巧合相似性或同源性的蛋白质也会发生交叉反应。特别是在竞争法分析中,因为只是用了一种抗体,交叉反应发挥更大的作用。为了确认此类分析,对经常可能发生的交叉反应物质和交叉反应需要被量化。
交叉反应也可以在蛋白印迹检测或免疫组化实验中发挥重要作用。尽管人们不知道在每种情况下,这些不必要的结合的确切分子机制,交叉反应在其他条带或细胞结构的染色中变得很明显。在蛋白印迹检测中,人们假设在许多情况下降解正确蛋白质的产物是自然的或合理的方式造成的。但在某些情况下,这并不是事实,我们需要考虑一抗或二抗的交叉反应。
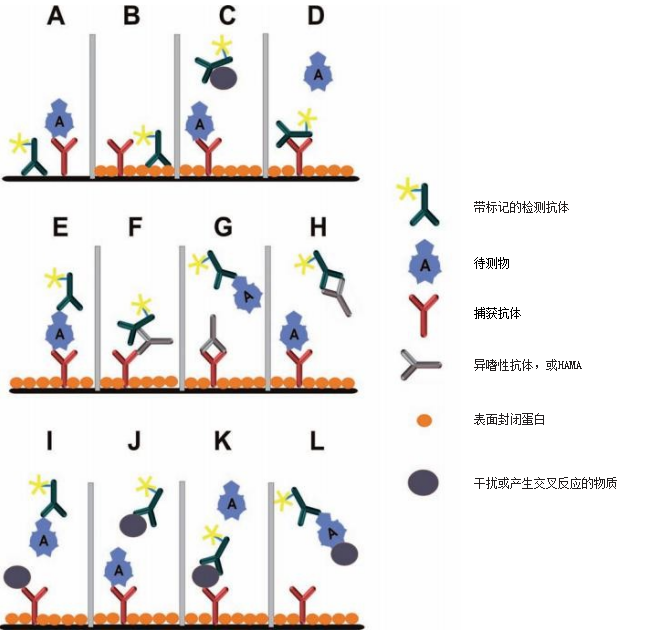
图 1: 在免疫分析中可能出现的不同干扰效应的示意图。
A: 标记的检测抗体与未封闭的表面的非特异性结合。结果是假阳性信号。
B: 标记的检测抗体与封闭表面的非特异性结合。尽管表面被封闭,但抗体与封闭蛋白相结合。结果是假阳性信号。
C: 干扰蛋白与检测抗体的 Fc 片段结合,并在空间上阻碍待测物的结合。结果是假阴性信号。
D: 捕获抗体与检测抗体的 Fc 片段结合。结果是假阳性信号。待检测物不能再与捕获抗体结合。
E: 不受影响的试验,没有任何干扰。理想的状态。
F: 通过异嗜性抗体或 HAMAs 进行的桥接结合。通过此方法,捕获抗体与检测抗体连接,从而产生假阳性信号。
G: 一种与捕获抗体具有抗独特型结合特性的 HAMA。干扰抗体结合在捕获抗体 Fab 片段的高度可变区域,从而阻止了待测物的结合。因此,就会出现假阴性信号。
H:一种与检测抗体具有抗独特型结合特性的 HAMA。干扰抗体结合在检测抗体 Fab 片段的高度可变区域,并阻止待测物的结合。结果,出现了假阴性信号。
I:干扰物质与捕获抗体的交叉反应性。结果是假阴性信号。
J:干扰物质与检测抗体的交叉反应性。结果是假阴性信号。
K:与捕获抗体和与检测抗体的交叉反应性。这种现象在实践中很少出现,这种抗体的特异性肯定较低。这种干扰现象也可以发生在待测物具有蛋白质保守氨基酸序列,该序列也出现在其他蛋白质上。
L:样本中的其他蛋白质掩蔽待测物,使其表位被封闭,无法与捕获抗体结合,或空间位阻情况严重。结果是假阴性信号。
非特异性结合带来的干扰
与交叉反应密切相关的是非特异性结合。然而,两者在分子水平上的机理有所不同。在日常的实验室工作中, 这些差异不明显。交叉反应中,造成交叉反应的物质是已知的,并且它的交叉反应性可以定量,譬如与交叉反应物的浓度竞争关系。而在非特异性结合的情况下,结合涉及的物质, 远远超过目标分析物 (如与白蛋白或免疫球蛋白的非特异性结合) 或与表面 (如 ELISA 孔或免疫印迹膜表面) 或蛋白质芯片中的固定抗体斑点。
基质效应
基质效应是样本中所含成分带来的干扰效应的总和,影响目标分析物的检测。如果产生干扰的真正分子原因还没有确定,但人们知道它来自于样本,那么一般就称之为「基质效应」。从一种效应到另一种效应的边界是不固定的,有时并不清晰。一些基质效应来自「抗动物抗体」,另一些来自异嗜性抗体,或来自内源性干扰,或仅仅来自粘度、ph 值或仅仅来自盐浓度。
抗动物抗体产生的干扰
人抗动物抗体 (HAAA) 可为 IgG-、IgA、IgM 或 IgE 型。它们是免疫系统应答的一部分,与动物来源的免疫球蛋白结合。HAAAs 在许多诊断性免疫分析中是众所周知的干扰物,有时可能是 80% 的临床标本的一部分——取决于具体应用研究。HAAAs 的浓度最高可达每毫升数毫克。
人抗小鼠抗体 (HAMA) 是免疫分析中最常见的干扰抗体。HAMAs 是人类抗体,具有显著的特异性,有时具有明显的小鼠抗体亲和力。患者体内产生这些抗体的原因通常是使用治疗性抗体药物治疗癌症而产生。用药后,患者的免疫系统会对这些外源性抗体产生反应,形成针对治疗性小鼠抗体的自身抗体。因此,如果免疫分析中使用小鼠抗体作为分析试剂, HAMAs 会干扰免疫检测结果。在使用小鼠单克隆抗体的夹心法分析中,这可 以导致捕获抗体和检测抗体之间的直接结合,而无需任何分析物 (图 1F)。这会导致假阳性信号。来自不同物种的抗体序列有相似之处。这意味着,含 HAMAs 的血清也可能会在使用来自其他物种的抗体的检测中产生问题,并产生同样的错误信号结果。
HAMAs 不仅来源于抗体治疗,长期接触家畜和宠物,最终也会形成针对这些动物的抗体。有人在患者的血清中发现了针对兔子、老鼠、狗、仓鼠的抗体。这些抗动物抗体干扰了一些具有不同亲和力和不同问题的检测抗体。一些干扰抗体不仅针对检测抗体的 Fc 片段,也针对检测抗体的 Fab 片段。这可能导致正确结合减少或完全阻碍,从而导致假阴性信号 (图 1 G 和 H)。如果 HAAAs 与 Fc 片段结合,它们被称为抗同型干扰。如果它们结合到高度可变的 Fab 片段上,它们就被称为抗独特型干扰
异嗜性抗体带来的干扰
泰伯医学词典将异嗜性抗体定义为「与特定抗原以外的其他抗原结合的抗体」。异型抗体可为 IgG、IgA、IgM 或 IgE 型。特别是 IgM 型在风湿病患者的血清中起着特殊的作用。这些血清中含有高浓度的所谓类风湿性因子。类风湿性因子是 IgM 抗体,可与人类抗体的 Fc 部分结合,因此也与实验中使用的抗体的 Fc 部分结合,且与物种无关。因此,风湿病血清将捕获与检测抗体连接起来,导致假阳性结果。这同时也是异嗜性抗体的一般干扰机制。风湿病血清的效应类似于 HAAAs 的效应。与 HAAAs 相比的区别在于异嗜性抗体的来源,他们不是建立在与动物免疫球蛋白反应的基础上,而是早期免疫应答的多特异性抗体或来源不明的干扰性抗体。
因 HAAAs 或异嗜性抗体造成的干扰被发现已有 30 多年。干扰抗体是来自动物源的一般弱结合抗体,主要干扰由于分析物浓度低,血清或血浆样本需低稀释度稀释的分析。向样本缓冲液中添加阻断物——通常是非特异性血清、抗体片段或高浓度的动物免疫球蛋白——能够通过竞争减少 HAAAs 或异嗜性抗体的干扰效应,但不能完全避免。
样品内源性物质带来的干扰
即使是标本中天然存在的蛋白质也会干扰免疫分析。人血清中众所周知的干扰物质有白蛋白、补体、溶菌酶和纤维蛋白原。低分子量的分析物可以与白蛋白结合,这使得抗体与分析物的结合变得困难。许多激素都与转运蛋 白结合,这也可能为免疫分析带来困难。此外,许多蛋白质具有结合其他物质和蛋白质的能力。这种结合能力通常是各自蛋白质生物学功能的重要组成部分。白蛋白、补体和 C 反应蛋白 (CRP) 是多种物质的天然受体。因此,非特异性结合甚至交叉反应——如与抗体的反应一样——都是可能发生的。这使得在免疫检测中识别某些分析物变得复杂。内源性 蛋白可以作为一种干扰因子与抗体结合 (图 1C,I-K) 或掩蔽目标分析物 (图 1L)。例如,溶菌酶能非特异性地与具有低等电点的蛋白质结合。因此,低等电点(约 5)的抗体可以与之结合,并在捕获抗体和检测抗体之间建立桥梁。需要提到的一个重要方面是,含有大量脂质的标本的干扰,因为一些分析物是脂溶性的,且抗体与分析物之间的结合可能也会受到脂质的影响。
相关产品推荐:
100 500 LowCross Buffer
180 500 Assay Defender